#Solutions #solute #solvent #concentration #molarity #equivalent #oxidation #reduction #molarmass #mole
Competencias a desarrollar por el estudiante:
- Explica los términos conceptuales de las disoluciones químicas
- Aplica la preparación de soluciones de concentración conocida y de disoluciones diluidas a partir de otra disolución concentrada.
Subnúcleos Temáticos
-
- Concepto y tipo de soluciones
- Solubilidad y miscibilidad: Electrolitos y no electrolitos
- Concentraciones en unidades físicas:
- Porcentaje: peso-peso, peso-volumen y volumen-volumen
- Unidades trazas: partes por mil, partes por millón, partes por billón, miligramos por ciento y miligramos por decilitro.
- Preparación de disoluciones y diluciones de concentración conocida expresadas en unidades físicas.
- Concentraciones en unidades químicas:
- mol y masa molar
- Concentraciones que relacionan cantidad de sustancia expresada en mol, equivalentes y sus múltiplos respecto al volumen de solución
- Función ρ
Conceptos básicos
Una solución es una mezcla homogénea, uniforme y estable, formada por dos o más sustancias denominadas componentes. 
Es una mezcla ya que las cantidades de los componentes no son fijas y porque no hay reacción química en la unión de componentes. Un ejemplo de mezcla puede ser el hecho de agregar polvo de chocolate a la leche; para obtener la bebida chocolatada no hay que agregar una cantidad concreta y tampoco se produce una reacción química al agregarlo; por esto es una mezcla.
En una disolución de una sustancia en otra, la sustancia disuelta se denomina soluto y la sustancia donde se disuelve denominada solvente.
El soluto es el componente que cambia de fase cuando se produce la disolución; también denominado cuerpo disperso, mientras que el solvente es el componente que disuelve, teniendo la propiedad de disolver ciertas sustancias.
Generalmente, la sustancia presente en mayor cantidad suele recibir el nombre de solvente, y la de menor cantidad se le llama soluto y es la sustancia disuelta.
Tipo de soluciones
Las soluciones se clasifican de acuerdo a:
- su estado físico
Se pueden distinguir seis (6) tipos de soluciones según el estado físico original (sólido, líquido o gaseoso) de los componentes.


2. Relación soluto – solvente
- Diluida: es la solución donde se disuelve una pequeña cantidad de sustancia en un volumen determinado de solvente
- Concentrada: es la solución donde se aumenta en forma apreciable la sustancia disuelta.
- Solución saturada: contiene la máxima cantidad de soluto que la que puede disolver un solvente en particular, a una temperatura específica
- Solución no saturada: contiene menos cantidad de soluto que la que puede disolver
- Solución sobresaturada: contiene más soluto que el que puede haber en una disolución saturada. No son muy estables, con el tiempo una parte del soluto se separa de la solución sobresaturada en forma de cristales.
Solubilidad y miscibilidad: electrolitos y no electrolitos.
Muchos sólidos tienen la propiedad de disolverse en algunos líquidos. Para Brown y LeMay (2004), la solubilidad molar es el nú mero de mol de soluto que se disuelven al formar un litro de una disolución saturada del soluto (mol/L).
Otra definición señala que la cantidad de soluto que se puede disolver en una cantidad determinada de un disolvente es limitada, por lo tanto la solubilidad es la facilidad que posee una sustancia para disolverse en otra. En general, la cantidad de una sustancia que podemos disolver en una cantidad fija de disolvente aumenta si elevamos la temperatura de la disolución. Sin embargo la solubilidad de los gases en los líquidos disminuye al aumentar la temperatura. La solubilidad se expresa en gramos de soluto por litro de disolución (g/L).
La miscibilidad es un término usado en química que se refiere a la propiedad de algunos líquidos para mezclarse en cualquier proporción, formando una solución homogénea. En principio, el término es también aplicado a otras fases (sólidos, gases), pero se emplea más a menudo para referirse a la solubilidad de un líquido en otro. El agua y el etanol, por ejemplo, son miscibles en cualquier proporción.
Por el contrario, se dice que las sustancias son inmiscibles sí en ninguna proporción son capaces de formar una fase homogénea. Por ejemplo, el éter etílico es en cierta medida soluble en agua, pero a estos dos solventes no se les considera miscibles dado que no son solubles en todas las proporciones.
Todos los solutos que se disuelven en agua se agrupan en dos categorías: electrolitos y no electrolitos. Un electrolito es una sustancia que, se disuelve en agua, forma una disolución que conduce electricidad. Un no electrolito no conduce la corriente eléctrica cuando se disuelve en agua. Los ácidos y bases son un ejemplo de sustancias electrolíticas.
| En fisiología, los iones primarios de los electrólitos son sodio (Na+), potasio (K+), calcio (Ca2+), magnesio (Mg2+), cloruro (Cl−), hidrógeno fosfato (HPO42−) y bicarbonato (HCO3−). Todas las formas de vida superiores requieren un sutil y complejo balance de electrólitos entre el medio intracelular y el extracelular. En particular, el mantenimiento de un gradiente osmótico preciso de electrólitos es importante. Tales gradientes afectan y regulan la hidratación del cuerpo, pH de la sangre y son críticos para las funciones de los nervios y los músculos. Existen varios mecanismos en las especies vivientes para mantener las concentraciones de los diferentes electrólitos bajo un control riguroso. Tanto el tejido muscular y las neuronas son considerados tejidos eléctricos del cuerpo. Los músculos y las neuronas son activados por la actividad de electrólitos entre el fluido extracelular o fluido intersticial y el fluido intracelular. Los electrólitos pueden entrar o salir a través de la membrana celular por medio de estructuras proteicas especializadas, incorporadas en la membrana, denominados canales iónicos. Por ejemplo, las contracciones musculares dependen de la presencia de calcio (Ca2+), sodio (Na+), y potasio (K+). Sin suficientes niveles de estos electrólitos clave, puede suceder debilidad muscular o severas contracciones musculares. |
Concentración
La concentración es la cantidad de soluto presente en una determinada cantidad de una disolución.
- Si la cantidad de soluto es relativamente baja, se tendrá una solución diluida.
- Si la cantidad de soluto es relativamente alta, se tendrá una solución concentrada.
- Si se tiene disuelta la máxima cantidad de soluto se tendrá una solución saturada.
- Si la cantidad de soluto está en exceso, se tendrá una solución sobresaturada (puede ocurrir en condiciones muy especiales de equilibrios meta estables).
La terminología anterior es vaga y arbitraria, por lo cual al ser variable la composición de una solución, es necesario especificar de manera numérica la concentración del soluto.
La concentración puede expresarse en varías unidades conocidas como:
- Unidades de concentración física
- Unidades de concentración química
Concentraciones en unidades físicas
Porcentaje peso – peso (%m/m)

Porcentaje peso – volumen (%m/v)

La densidad: es una propiedad intensiva de la materia definida como la relación de la masa de un objeto dividida por su volumen. Las unidades comunes usadas para expresar la densidad son gramos por mililitros (g/mL) y gramos por centímetros cúbicos (g/cm3). Se expresa mediante la siguiente fórmula matemática:  |
Porcentaje volumen – volumen (%v/v)

Unidades traza
Para expresar concentraciones muy pequeñas, traza de una sustancia muy diluida en otra, es común emplear las relaciones:
-
Partes por millón (ppm)
Es la unidad empleada usualmente para valorar la presencia de elementos en pequeñas cantidades (traza) en una mezcla. Generalmente suele referirse a porcentajes en masa en el caso de sólidos y en volumen en el caso de gases. También se puede definir como «la cantidad de materia contenida en una parte sobre un total de un millón de partes.
-
- Vale aclarar que deben concordar las unidades de masa en el numerador y denominador.
- Una regla útil en el cálculo de las partes por millón es recordar que para disoluciones acuosas diluidas con densidad aproximada de 1 g/mL se tiene que 1 ppm = 1 mg/L
- Técnicamente, 1 ppm corresponde a 1 µg/g, 1 mg/kg o (en el caso del agua) 1 µl/L.
-
Miligramos por decilitro.
Una unidad de medida que muestra la concentración de una sustancia en una cantidad concreta de líquido. Por ejemplo, los resultados de los análisis de niveles de glucosa en sangre se reportan en forma de mg/dL.

| Un ejemplo del empleo de las unidades trazas: Valores normales para un estudio de química sanguínea (ver unidades) Albúmina: 3.9 a 5.0 mg/dL BUN (urea en la sangre): 7 a 20 mg/dL Calcio en suero: 8.5 a 10.9 mg/dL Cloruro en suero: 101 a 111 mmol/L CO2 (dióxido de carbono): 20 a 29 mmol/L Creatinina: 0.8 a 1.4 mg/dL ** Bilirrubina directa: 0.0 a 0.3 mg/dL Examen de glucosa: 64 a 128 mg/dL Fósforo en suero: 2.4 a 4.1 mg/dL Examen de potasio: 3.7 a 5.2 mEq/L Sodio en suero: 136 a 144 mEq/L | Unidades y equivalencia L = litro; dL = decilitro g/dL = gramos por decilitro mg = miligramos mmol = milimoles mEq = miliequivalentes 1dL = 0,1 L 1dL = 100 mL 1 L = 10 dL |
Mol y masa molar
El mol (n) es la unidad del sistema internacional (SI) para la cantidad de una especie química. Se relaciona siempre con una fórmula química y representa el número de Avogadro (6,022×1023) de partículas que simboliza esa fórmula.
La masa molar (M) es la cantidad de masa que una sustancia contiene en un mol. La masa molar se calcula al sumar las masas atómicas de cada uno de los átomos de una fórmula química. Su unidad de medida en el SI es kilogramo por mol (kg/mol o kg·mol−1). Sin embargo, por razones históricas, la masa molar es expresada casi siempre en gramos por mol (g/mol).
En ocasiones resulta más conveniente efectuar cálculos con milimoles (mmol) que con moles; el milimol es 1/1000 de 1 mol. La masa en gramos de un milimol, la masa milimolar (mM), es de igual manera 1/1000 de la masa molar.
Concentraciones que relacionan cantidad de sustancia expresada en moles, equivalentes y sus múltiplos respecto al volumen de solución
Los profesionales analíticos expresan de diversas maneras la concentración de especies en disolución. Las más importantes se describen a continuación:
Concentración molar
La concentración molar cx de una especie química X en disolución X, es el número de mol de la especie contenida en 1 litro de la solución (no en un 1 litro de solvente). La unidad de concentración molar es la molaridad, que tiene las unidades de mol/L. La molaridad también expresa el número de milimoles de soluto por mililitro de disolución.

El número de mol de soluto se calcula:
Dónde: n= cantidad de sustancia (expresada en mol o mmol); v = volumen de la solución (expresado en L o mL); m = masa de soluto (expresada en g); M = masa molar (expresada en g/mol).
Normalidad (eg-g/L)
Expresar la concentración de una solución en unidades de normalidad viene en desuso, aunque todavía sigue bastante extendida. La concentración normal, indica el número de equivalentes de soluto contenidos en un 1litro de solución. Se expresa matemáticamente como:
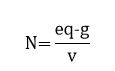


donde: eq-g = equivalente gramo, v = volumen de la solución (L), Peq = peso equivalente, M = masa molar, N° = número.
Se puede realizar la conversión de normalidad a molaridad y viceversa, utilizando la siguiente ecuación:
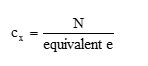
Asimismo, se puede realizar la conversión de eq-g a mol y viceversa, utilizando la siguiente ecuación:
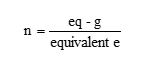
Función p
Los científicos suelen expresar la concentración de una especie en términos de su función p o valor p. Este valor es el logaritmo (base 10) negativo de la concentración molar de especie. Así, para la especie X.
![]()
Los valores p tienen la ventaja de permitir expresar con números positivos pequeños concentraciones que varían en 10 o más órdenes de magnitud.
Reacciones de oxidación-reducción, número de oxidación, peso equivalente de un ácido, base, sal, agentes oxidantes y reductores.
Ocurren reacciones de oxidación –reducción (redox) cuando las sustancias que se combinan intercambian electrones. De manera simultánea, con dicho intercambio, tiene lugar una variación en el número de oxidación (estado de oxidación) de las especies químicas que reaccionan. El manejo del número de oxidación es imprescindible para el balanceo de las reacciones redox.
El número de oxidación puede definirse como la carga real o virtual que tienen las especies químicas (átomos, moléculas, iones) que forman las sustancias puras. Esta carga se determina con base en la electronegatividad1 de las especies según las reglas siguientes.
Reglas para la asignación del número de oxidación:
- Los elementos libres, sin combinar, presentan estado de oxidación (E.O) igual a cero (neutros). Igualmente ocurre si están combinados consigo mismo. Por ejemplo: Fe0, Mg0, Ca0, H20, N20, O20, Cl20, I20, P40
- El hidrógeno (H) presenta E. O igual a +1 en la mayoría de sus compuestos, excepto cuando esta combinado con un elemento más electropositivo como son los metales alcalinos (Li, Na, K, Ca), donde su número de oxidación se estima en -1
- El oxígeno presenta E.O -2 en la mayoría de los compuestos, excepto en peróxidos donde tiene carga -1, y en caso de los superóxidos el oxígeno tiene carga de -½.
-
- Peróxidos: XO2 = X+2; (O2)-2 => Grupo II (grupo 2) de la tabla periódica.
- Superóxidos: XO2 = X+1; (O2)-1 => Grupo I (grupo 1) de la tabla periódica.
- Los elementos del grupo I-A (grupo 1) presentan E.O +1, en todos los compuestos. Los elementos del grupo II-A (grupo 2) presentan E.O + 2 en todos sus compuestos y los del III-A (grupo 13) presentan E.O +3
- Los elementos del grupo VII-A (grupo 17) en los compuestos binarios, los haluros presentan E.O – 1 y los del VI-A (grupo 16), en los compuestos binarios presentan E.O – 2
- En los compuestos la suma de los estados de oxidación de los elementos constituyentes es igual a cero, ya que los compuestos son neutros,
- En los iones complejos, formados por más de un elemento, la suma de los E.O es igual a la carga del ion.
Número equivalente (N° equivalente)
La normalidad es una unidad de concentración que depende de la reacción en la que participará la solución y requiere que se dominen las siguientes definiciones:
- Equivalente de un ácido: Es la cantidad de mol de H + proporcionado por un mol de ácido cuando se disuelve en agua.
- Equivalente de una base: Es la cantidad de mol de OH– proporcionados por un mol de base cuando se disuelve en agua.
- Equivalente de una sal: Es la cantidad de mol de cargas positivas proporcionada por un mol de sal al disolverse en agua.
- Equivalente para compuestos que actúan en una reacción REDOX. Es la cantidad de mol de electrones transferidos cuando se oxida o se reduce un mol de compuesto.
Agente oxidante
Es la especie química que un proceso redox acepta electrones y, por tanto, se reduce en dicho proceso. Por ejemplo, cuando se hacen reaccionar cloro elemental con calcio:
Ca0 + Cl2 →CaCl2
El cloro es el agente oxidante puesto que, gana electrones y su carga o número de oxidación pasa de 0 a -1. Esto se puede escribir como:
2e-+Cl2 → 2Cl -1
En resumen:
- Gana electrones
- Disminuye su número de oxidación
Agente reductor
Es la especie química que un proceso redox pierde electrones y, por tanto, se oxida en dicho proceso (aumenta su número de oxidación). Por ejemplo, cuando se hacen reaccionar cloro elemental con calcio:
Ca0 + Cl2 →CaCl2
El calcio es el agente reductor puesto que pierde electrones y su carga o número de oxidación pasa de 0 a +2. Esto se puede escribir como:
Ca0 → Ca+2 + 2e-
En resumen:
- Pierde electrones
- Aumenta su número de oxidación
ACTIVIDADES
Repaso de conceptos
Seleccione la respuesta que corresponda. Coteje sus respuestas con las que aparecen al final de esta guía de estudios.
- Una solución es una mezcla:
- Homogénea
- Heterogénea
- Heterogénea de dos fases
- El soluto es la sustancia que generalmente dentro de una solución se encuentra presente en:
- Menor proporción.
- Mayor proporción
- Igual proporción que el solvente.
- El solvente es la sustancia que generalmente dentro de una solución se encuentra presente en:
- Menor proporción.
- Mayor proporción
- Igual proporción que el soluto.
- Una mezcla de oxígeno y agua se considera un ejemplo de un tipo de solución:
- Sólido – líquido
- Líquido –líquido
- Líquido – gas
- Cuando un sólido se disuelve en un líquido:
- Las partículas que lo forman quedan libres y se reparten entre las moléculas del líquido que se sitúa a su alrededor.
- Las partículas que lo forman quedan libres y se posicionan encima de las moléculas del líquido.
- Las partículas que lo forman quedan libres y se posicionan debajo de las moléculas del líquido.
- Si la cantidad de soluto es relativamente baja se tendrá una:
- Solución concentrada
- Solución diluida
- Solución sobresaturada.
- Las soluciones se clasifican de acuerdo con su estado físico en:
- Concentrada y diluida
- Insaturada, saturada y sobresaturada
- Gaseosas, líquidas y sólidas.
- El soluto en una solución:
- Puede observarse a simple vista.
- Puede observarse usando microscopio.
- No puede observarse ni con el ultramicroscopio.
- En aquellos casos en los que pueda existir duda sobre quién es el soluto y quién el solvente:
- Se considera solvente al componente que está en menor proporción.
- Se considera solvente cualquiera de los dos componentes.
- Se considera solvente al componente que este en mayor proporción.
- Las soluciones se clasifican de acuerdo a su relación soluto – solvente en:
- Coloidales y dispersiones
- Insaturada, saturada y sobresaturada
- Gaseosas, líquidas y sólidas.
Preparación de disoluciones y diluciones de concentración conocida expresadas en unidades químicas.
- Calcular los gramos de permanganato de potasio (KMnO4) necesarios para preparar 100 mL de concentración 0,500 mol/L
- Calcular los gramos de carbonato de sodio (Na2CO3) necesarios para preparar 500 mL de concentración 0,250 mol/L
- Calcular los gramos de carbonato de sodio decahidratado (Na2CO3.10H2O) necesarios para preparar 500 mL de concentración 0,250 mol/L
- Determine el volumen de ácido clorhídrico (HCl) concentrado que debe utilizar para preparar 100 mL de solución de ácido clorhídrico de concentración 0,100 mol/L
- Explique cómo prepararía 1000 mL de una solución de cloruro de sodio, NaCl 0,15 mol/L y de densidad 1,19 g/mL, a partir de sus componentes.
- ¿Cuál es la concentración en mol/L que tendrá una solución que contiene 100 g de sulfato de sodio, Na2SO4 presentes en 500 mL de solución?
- ¿Cuál es la concentración en mol/L de una solución que se preparó disolviendo 20 g de hidróxido de aluminio, Al(OH)3 en 150 mL de solución?
- Calcular los gramos de hidróxido de bario, Ba(OH)2 necesarios para preparar 2,5 L de solución de hidróxido de bario de concentración 0,07 mol/L.
- ¿Cuántos gramos de hidróxido de sodio, NaOH se necesitan para preparar 300 mL de una solución acuosa cuya concentración sea 0,12 mol/L?
- Explique cómo prepararía 1000 mL de una solución de cloruro de sodio, NaCl 0,15 mol/L y de densidad 1,19 g/mL, a partir de sus componentes.
- ¿Cuántos gramos permanganato de potasio, KMnO4 (como agente oxidante) se necesitan para preparar 500 mL de una solución de ácido 0,100 eg-g/L?
MnO4– + 8H+ + 5e– → Mn2+ + 4 H2O
- ¿Cuál es la concentración en mol/L que tendrá una solución que contiene 100 g de sulfato de sodio, Na2SO4 presentes en 500 mL de solución?
- ¿Cuál es la concentración en mol/L de una solución que se preparó disolviendo 20 g de hidróxido de aluminio, Al(OH)3 en 150 mL de solución?
- Se dispone de un matraz de capacidad de un litro. En dicho matraz se coloca 150 mL de una solución de ácido clorhídrico 0,1 eq-g/L, luego se completa con agua hasta la línea de aforo. De esta solución se toman 500 mL y se colocan en un matraz aforado de capacidad de un litro y luego se añaden 200 mL de solución de HCl 0,5 mol/L y 300 mL de HCl 0,15 mol/L. Determine la concentración resultante en unidades de mol/L.
- Se tienen 200 mL de una solución de ácido nítrico (HNO3) al 85% m/m y una densidad de 1,1 g/cm3. De esta solución se toman 50 mL y se le añade agua hasta completarse un volumen de 250 mL de solución B. De la solución B se toman 150 mL y se colocan en un matraz aforado y se le añade agua hasta completarse 200 mL de solución C. Calcule la concentración en unidades de mol/L de las soluciones A, B, C.
- Describa la preparación de 2000 L de AgNO3 0,0500 M (169,87 g/mol) a partir del sólido patrón primario.
- Se requiere una disolución patrón de Na+ 0,0100 M para calibrar un método fotométrico de llama con el fin de determinar sodio. Describa cómo se pueden preparar 500 mL de disolución a partir del patrón primario Na2CO3 (105,99 g/mol)
- ¿Cómo prepararía disoluciones patrón de 50,0 mL que sean 0,00500, 0,00200 y 0,00100 M en Na+ a partir de la solución del ejercicio anterior (10)
- Una alícuota de 50,0 mL de una disolución de HCl requirió 29,71 mL de Ba(OH)2 0,01963 M para alcanzar el punto final con el indicador verde de bromocresol. Calcule la molaridad del ácido clorhídrico.
- La valoración de 0,2121 g de Na2C2O4 puro (134,00 g/mol) requirió 43,3 mL de KMnO4. ¿Cuál es la concentración molar de la solución de KMnO4? La reacción química es la siguiente:
2MnO4– + 5C2O42- + 16H+ → 2Mn2+ + 10 CO2 + 8 H2O
Respuestas del repaso de conceptos.
- a.
- a.
- b.
- c.
- a.
- b.
- c.
- c.
- c.
- b.
Criterios de evaluación
De 10 a 7 preguntas correctas: Puede pasar a la siguiente parte del módulo
Menos de 7: Repase la información y repita el ejercicio
Referencias
- Brown, T., LeMay, H. (2004). Química. La ciencia central. México: Pearson Prentice Hall
- González, A. (2006). Módulo Instruccional para el Aprendizaje del Tema Soluciones de la Cátedra Química I (Versión aplicada a la Química General). Ciudad Bolívar: UDO Bolívar.
- Skoog D., West D. (1983).Fundamentos de química analítica. Venezuela: Editorial Reverté.
- Skoog D, West D, Holler F., Crouch S. (2005).Fundamentos de química analítica. México: Thomson
- “Partes por millón”. Disponible: http://es.wikipedia.org/wiki/Partes_por_mill%C3%B3n. [Consulta: 2009, mayo 17].
- Merck Source. (2009). “Estudio ampliado de química sanguínea (CHEM-20)”. Disponible:http://www.mercksource.com/pp/us/cns/cns_hl_adam.jspzQzpgzEzzSzppdocszSzuszSzcnszSzcontentzSzadamfullzSzadam_ency_espzSz5zSz003468zPzhtm. [Consulta: 2009, mayo 17].