Competencias a desarrollar por el estudiante:
- Explica la teoría de la disolución electrolítica.
- Explica la actividad y coeficiente de actividad.
Subnúcleos Temáticos
- Teoría de la disolución electrolítica
- Ley de acción de masas.
- Equilibrio en sistemas heterogéneos.
- Grado de disociación de una electrolito débil y fuerte.
- Cambios en el equilibrio iónico.
- Temperatura
- Presión
- Catalizadores
- Principio de Le Chatelier
- Efecto del ión común
- Efecto de la concentración
- Actividad y coeficiente de actividad.
LEY DE ACCIÓN DE MASAS
Supóngase que se tiene la siguiente reacción general donde las letras mayúsculas representan fórmulas y las minúsculas representan los coeficientes estequiométricos en la ecuación ajustada:
aA+bB → cC + dD
La flecha indica que la reacción es NO REVERSIBLE, es decir, sólo ocurre la reacción directa. Todos los reactantes se transforman en productos y la reacción finaliza cuando se terminan los reactantes. 
Teóricamente, todas las reacciones químicas son reversibles, esto es, existe la posibilidad de que los átomos de las moléculas resultantes de la reacción se reagrupen nuevamente para formar las moléculas de los reaccionantes.
La mayoría de las reacciones químicas no llegan a completarse. Esto, es, cuando se mezclan los reactivos en cantidades estequiométricas, no se convierten completamente en productos. Las reacciones que no llegan a completarse y que tienen lugar en ambos sentidos se llaman REACCIONES REVERSIBLES.
aA+bB ⇔ cC + dD
La doble flecha indica que la reacción es reversible, es decir, tanto la reacción directa como la inversa ocurren simultáneamente (los reactantes se transforman en productos y éstos a su vez en reactantes). La reacción finaliza con la coexistencia de todos los componentes del sistema, cuando alcanza el equilibrio químico.
El EQUILIBRIO QUÍMICO, se produce cuando dos reacciones opuestas tienen lugar simultáneamente a la misma velocidad.
TEN PRESENTE QUE: Los equilibrios químicos son equilibrios dinámicos, esto es, las moléculas individuales están reaccionando constantemente aunque la composición global de la mezcla de reacción no cambia. No debe confundirse éste equilibrio con el equilibrio estático, de las poleas y palancas.
La reacción directa ocurre cuando el equilibrio está desplazado a la derecha, en este caso hay más C y D presentes que A y B
aA+bB → cC + dD (Reacción directa)
y la reacción es inversa cuando el equilibrio está desplazado a la izquierda, es decir, si hay más A y B
aA+bB ← cC + dD (Reacción inversa)
Ahora supongamos que:
aA+bB ⇔ cC + dD
Tiene lugar mediante un mecanismo de un solo paso a una temperatura dada, la velocidad de la reacción hacia la derecha es:
![]()
La velocidad de la reacción inversa es:

Kreactivos y Kproductos, son constantes específicas de la reacción directa e inversa, respectivamente. Sabemos que por definición las dos velocidades son iguales en el equilibrio. De modo que podemos escribir:
![]()
despejando obtenemos:
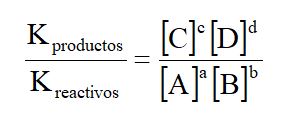
A una temperatura determinada tanto Kproductos como Kreactivos son constantes así:

Donde la K es la constante del Equilibrio:

La ecuación anterior, es la expresión matemática de la “LEY DE LA ACCIÓN DE MASAS”, propuesta por los químicos noruegos Cato Gulberg y Peter Waage en 1864.
La Ley de Acción de Masas, establece que: “…para una reacción reversible en equilibrio y a una temperatura constante, una relación determinada de concentraciones de reactivos y productos tiene un valor constante K (la constante de equilibrio).”
El valor de la constante de equilibrio, K, permanecerá constante, siempre y cuando la reacción esté en equilibrio y la temperatura no cambie, por lo tanto, es independiente de las concentraciones de los reactivos y productos.
La magnitud de la constante de equilibrio, K, indica si una reacción en equilibrio es favorable a los productos o a los reactivos.
- Si K, es mucho mayor que 1, el equilibrio se desplazará hacia la derecha y favorecerá a los productos (reacción directa).
- Si la constante de equilibrio es mucho menor que 1, el equilibrio se desplazará a la izquierda y favorecerá a los reactivos (reacción inversa).
Utilizaremos la convención recomendada por Chang R. donde cualquier número mayor que 10 se considera mucho mayor que 1, y un número menor que 0,1, se considera mucho menor que 1.
EQUILIBRIOS HOMOGÉNEOS.
El término equilibrio homogéneo se aplica a las reacciones en las que todas las especies reaccionantes se encuentran en la misma fase. Un ejemplo de este tipo de equilibrio en fase gaseosa es la disociación del tetraóxido de dinitrógeno, N2O4.
N2O4(g) ⇔ 2NO2(g)
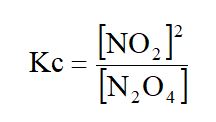
El subíndice en Kc, inda que las concentraciones de las especies reaccionantes se expresan en mol/L.
EQUILIBRIOS HETEROGÉNOS
Una reacción reversible en la que intervienen reactivos y productos en distintas fases conduce a un equilibrio heterogéneo. Por ejemplo, cuando el carbonato de calcio se calienta en un recipiente cerrado, establece el siguiente equilibrio:
CaCO3(s) ⇔ CaO(s) + CO2(g)
Los dos sólidos y el gas constituyen tres fases distintas. En el equilibrio se puede esperar que la constante de equilibrio sea:
![]()

La concentración de un sólido es una propiedad intensiva y no depende de la cantidad de sustancia presente. Por estas razones las concentraciones de las especies sólidas son una constante y se pueden combinar con la constante de equilibrio. La misma consideración se aplica a los líquidos, así, sí un líquido es un reactivo o un producto, su concentración se puede considerar como constante y omitirla en la expresión de la constante de equilibrio.
GRADO DE DISOCIACIÓN DE UNA ELECTROLITO DÉBIL Y FUERTE
La mayoría de los compuestos inorgánicos cristalinos están formados por iones, es decir, partículas con cargas eléctricas producidas cuando un átomo o grupo de átomos, pierde o gana electrones, originándose iones positivos (cationes) o negativos (aniones). La atracción electrostática mantiene unidos los iones en el cristal. Los cristales iónicos fundidos conducen la electricidad; también las soluciones en agua u otros disolventes polares de las sustancias iónicas son conductores de electricidad, por lo que se les nombra electrólitos.
La fuerza solvatadora o capacidad dieléctrica de un solvente tiende a separar los iones (ionización) dejándolos moverse libremente en el seno de la disolución. Para un determinado solvente y una determinada concentración, el grado de disociación o ionización de una sustancia iónica depende de la naturaleza de sus iones.
Las sustancias iónicas que se consideran totalmente disociadas, se denominan electrólitos fuertes y las que se consideran muy poco disociadas, electrólitos débiles.
En los electrolitos débiles, la potente y mutua atracción electrostática entre iones de carga contraria, aunque están solvatados (hidratados cuando el disolvente es agua), tiende a juntarlos formando la sustancia iónica inicial. Este fenómeno electrostático origina un equilibrio dinámico entre el compuesto iónico y sus iones positivos (cationes) y negativos (aniones), a los que pueden aplicárseles los principios del equilibrio químico y la ley de acción de masas.
Consideremos varios ejemplos de soluciones diluidas de electrolitos fuertes:
- Una solución 0,1 mol/L de NaCl:

- Una solución 0,05 mol/L de NaCl:

- Una solución de sulfato de potasio ( K2SO4) 0,1 mol/L
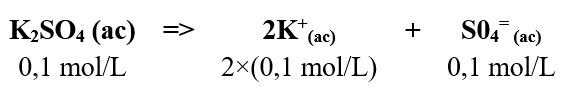
Conviene recordar que al disociarse 1 mol de K2SO4 produce dos iones potasio, hecho que duplica su concentración y además produce un ion sulfato.
Para las soluciones de electrólitos débiles se establece un sistema en equilibrio entre iones asociados (molécula) e iones disociados. La constante de equilibrio es llamada constante de disociación o ionización. Así la disociación del electrólito débil AB se representa por:
AB ⇔ A+ + B–
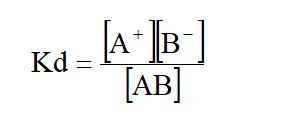
El grado de disociación de AB es igual a la concentración de A+ o B– en mol/L en que se disocia, dividido entre la concentración inicial de AB. En este caso,

- [A+]o = concentración en el equilibrio de A+
- [AB]o = concentración inicial de AB.
Por la estequiometria de la reacción, el número de mol de AB que se disocia es igual al número de mol de A+ o B– formado.
LEY DE ACCIÓN DE MASAS (aplicación en la Química Analítica)
En química analítica la mayoría de las reacciones son reversibles, los cálculos relacionados con la ley de masas normalmente se refieren a equilibrio de electrolitos en solución. Cuando la ley de acción de masas se aplica a las soluciones diluidas, que son las que corrientemente se manejan en química analítica, apenas se pierde exactitud en el cálculo utilizando las concentraciones expresadas en mol de soluto por litro de solución.
En general, cuando interviene una sustancia sólida en un equilibrio químico, su concentración no se encuentra comprendida en la fórmula, ya que es esencialmente una constante y su actividad se toma como la unidad. Esto mismo es válido para el agua en soluciones diluidas. Así, la constante de equilibrio de:
CO3-2 + H2O ⇔ HCO3– + – OH
Es simplemente:

CAMBIOS EN EL EQUILIBRIO IÓNICO
El equilibrio químico representa un balance entre las reacciones directa e inversa. En la mayoría de los casos, este balance es muy delicado. Los cambios en las condiciones experimentales pueden alterar el balance y desplazar la posición del equilibrio para hacer que se forme mayor o menor cantidad del producto deseado.
El equilibrio químico representa un balance entre las reacciones directa e inversa. En la mayoría de los casos, este balance es muy delicado. Los cambios en las condiciones experimentales pueden alterar el balance y desplazar la posición del equilibrio para hacer que se forme mayor o menor cantidad del producto deseado.
Principio de Le Chatelier
Existe una regla general que ayuda a predecir la dirección en la que se desplazará una reacción en equilibrio cuando hay un cambio de concentración, presión, volumen o temperatura. Esta regla, conocida como principio de Le Chatelier, establece que si se aplica una tensión externa a un sistema en equilibrio, el sistema se ajusta de tal manera que se cancela parcialmente dicha tensión.
El cociente de reacción Q, nos permitirá predecir el sentido de la respuesta del sistema a cualquier tensión.
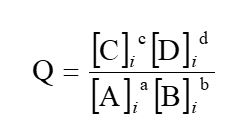
- Si Q>K, la reacción es inversa,
- si Q<K la reacción es directa,
- si Q=K, el sistema está en equilibrio.
El término tensión significa un cambio de concentración, presión, volumen o temperatura que altera el equilibrio de un sistema.
Cambios en la concentración
Considere el siguiente equilibrio:
aA+bB ⇔ cC + dD

Si se añade más reactivo o producto al sistema, los cambios se aminorizan desplazando el equilibrio en la dirección que consume algo de la sustancia añadida.

Cuando se establece un “nuevo equilibrio”, a) las velocidades de las reacciones directa e inversa son de nuevo iguales, b) la constante de equilibrio, K, se satisface de nuevo por las concentraciones de reactivos y productos.
Cambios de presión y volumen
Los cambios de presión tienen poco efecto en las concentraciones de sólidos o líquidos porque son ligeramente compresibles, sin embargo, cambios en la presión sí originan cambios significativos en las concentraciones de los gases. Por tanto, tales cambios afectan al valor del cociente Q para las reacciones en las que el número de mol de reactivos gaseosos difiere del número de mol de productos gaseosos.
Para un gas ideal, PV = nRT
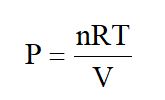
El término (n/V) representa la concentración, es decir, mol/L. A temperatura constante n, R y T son constantes. Así, si el volumen ocupado por un gas disminuye, su presión parcial aumenta y su concentración aumenta. Si el volumen de gas aumenta, tanto su presión parcial como su concentración disminuyen.
Considere el siguiente equilibrio:
A(g) ⇔ 2D(g)


Si no hay un cambio en el número de mol de los gases en la reacción, un cambio de volumen (presión) no afecta a la posición del equilibrio.
Cambios de Temperatura
ΔH (Entalpía): es una cantidad termodinámica que se utiliza para describir los cambios térmicos que se realizan a presión constante.
Reacción exotérmica:
Considere el siguiente equilibrio:
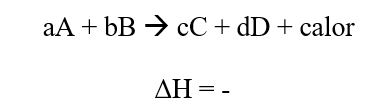
Se produce calor en la reacción directa (exotérmica). Suponga que se aumenta la temperatura a presión constante por adición de calor al sistema. Esto favorece la reacción inversa, eliminando algo del calor sobrante. Si por el contrario, se disminuye la temperatura, se favorece la reacción directa a medida que el sistema repone parte del calor que se eliminó.
Reacción endotérmica:
Considere el siguiente equilibrio:
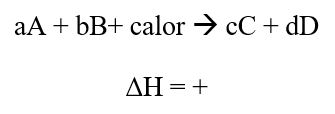
Un aumento de temperatura a presión constante favorece la reacción directa. Un descenso de temperatura favorece a la reacción inversa.
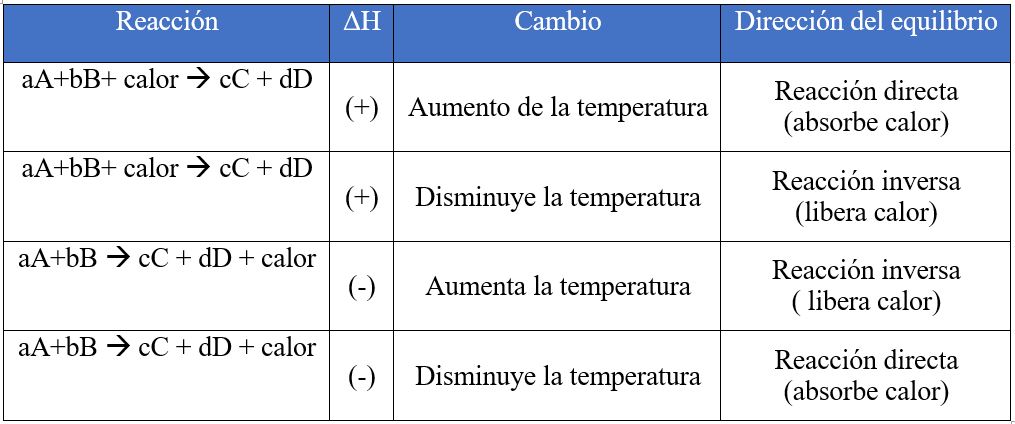
Los cambios de concentración, presión o volumen, pueden alterar la posición del equilibrio pero no cambian el valor de la constante de equilibrio (K). Sólo un cambio de temperatura puede alterar esta constante.
Si se aumenta la temperatura de un sistema en equilibrio este se desplazará en el sentido que absorba calor (ley de Van’t Hoff).
Cambios por Catalizador
Un catalizador aumenta la velocidad de una reacción al reducir la energía de activación de la reacción. Sin embargo, un catalizador disminuye la energía de activación de la reacción directa y de la reacción inversa en la misma magnitud. Se puede concluir que la presencia de un catalizador no altera la constante de equilibrio, como tampoco desplaza la posición de un sistema en equilibrio. El hecho de añadir un catalizador a una mezcla de reacción que no está en equilibrio sólo provocará que la mezcla alcance más rápido el equilibrio. La misma mezcla en equilibrio se obtendría sin el catalizador, pero habría que esperar más tiempo.
Efecto del ion común
Es el desplazamiento del equilibrio causado por la adición de un compuesto que tiene un ion en común con las sustancias disueltas.
Supongamos que se estudia una disolución en la que están disueltas dos sustancias que tiene un ion en común, por ejemplo: cloruro de plata (AgCl) y nitrato de plata (AgNO3). Además de la disociación del AgCl, el siguiente proceso también contribuye a la concentración total de los iones plata (el ion común) en la disolución.

Si el AgNO3 se agrega a una disolución saturada de AgCl, el incremento de la concentración de los iones plata hará que el producto iónico sea mayor que el producto de solubilidad.
Q = [Ag+]i [Cl–]i > Kps
Para restablecer el equilibrio, precipitará una parte de AgCl, como lo predice el Principio de Le Chatelier, hasta que el producto iónico de nuevo sea igual a la constante de equilibrio, Kps, por lo tanto, el efecto de ion común es disminuir la solubilidad de la sal en la disolución.
ACTIVIDAD Y COEFICIENTE DE ACTIVIDAD.
En química analítica, los cálculos relacionados con la ley de masas normalmente se refieren a equilibrios de electrolitos en solución. A medida que las soluciones de los electrolitos se hacen más concentradas, el efecto cuantitativo sobre propiedades como la conductividad es progresivamente menor que el calculado a partir únicamente del cambio total de la concentración molar.
Hipotéticamente, la mayoría de las sales y los denominados ácidos y bases fuertes están totalmente ionizados en solución acuosa, pero la concentración efectiva o actividad, de los iones disminuye, debido a fuerzas de atracción entre los iones positivos y negativos. Estas fuerzas disminuyen a medida que la dilución es mayor, ya que lo iones se encuentran más distantes entre sí.
Por esta razón, cuando se realizan trabajos de precisión, la ley de masas suele expresar en actividades o concentraciones efectivas, en vez de concentraciones molares. La actividad α de un ion o molécula resulta de multiplica su concentración molar, Cx por un coeficiente de actividad, γ.
α= γCx
El coeficiente de actividad, γ es por tanto un factor que convierte una concentración en un valor que expresa cuantitativamente el efecto verdadero de la acción de las masas. Así, por ejemplo, la expresión correcta de la constante de ionización para la siguiente ecuación
AB ⇔ A+ + B–
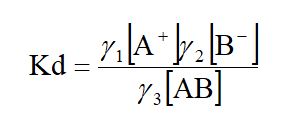
En donde γ1, γ2 y γ3 son los coeficientes de actividad de los iones y la molécula, respectivamente. Los coeficientes de actividad varían con la temperatura y, en general, disminuyen al aumentar la concentración. En el caso de soluciones relativamente diluidas, y en particular tratándose de iones univalentes, los coeficientes de actividad están próximos a la unidad, por lo que no se introducen serios errores cuando se emplean concentraciones en lugar de actividades. Como la mayoría de las operaciones analíticas las concentraciones son bastante bajas, y dado que rara vez es necesaria un alto grado de precisión en los cálculos relativos a las constantes de la ley de masas, se puede omitir los coeficientes de actividad sin cometer errores excesivos.
ACTIVIDADES PROPUESTAS:
Ley de acción de masas: equilibrio homogéneo y equilibrio heterogéneo
- Escriba las expresiones de la constante de equilibrio Kc que corresponda a cada uno de los siguientes sistemas heterogéneos:
-
- (NH4)2Se(s) ó 2NH3(g) + H2Se(g)
- AgCl (s) ó Ag+(ac) + Cl–(ac)
- P4(s) + 6Cl2(g) ó 4PCl3(l)
2. Para la reacción: H2(g) +I2(g) ó 2HI(g) en una experiencia realizada a 490ºC, se ha encontrado que las concentraciones en el equilibrio fueron: [H2] = 0,000862 mol/L, [I2]= 0,00263mol/L y [HI] = 0,0102 mol/L. Hallar la constante de equilibrio Kc a 490ºC. Respuesta: 45,9
3. Se ha estudiado el siguiente proceso en equilibrio a 230°C:
2NO(g) + O2(g) ⇔ 2NO2(g)
En un experimento se encontró que las concentraciones en equilibrio de las especies reaccionantes son [NO] = 0,0542 mol/L, [O2] = 0,127 mol/L, [NO2] = 15,5 mol/L. Calcule la constante de equilibrio Kc de la reacción a esta temperatura. Respuesta: 6,44×105
4. El cloruro de carbonilo (COCl2), también llamado fosgeno, se utilizó en la primera guerra mundial como gas venenoso. Las concentraciones en equilibrio a 74°C para la reacción entre el monóxido de carbono y el cloro molecular que produce cloruro de carbonilo: CO(g) + Cl2(g) ⇔COCl2(g), son [CO] = 1,2×10-2 mol/L, [Cl2] = 0,054 mol/L, [COCl2] = 0,14 mol/L. Calcule la constante de equilibrio. Respuesta:
5. En un recipiente de 10 L de capacidad se hicieron reaccionar 0,5 mol de H2(g) y 0,5 mol de I2(g) a una temperatura de 44ºC. La constante de equilibrio Kc a dicha temperatura tiene un valor de 50. La reacción es H2(g) +I2(g) ó 2HI(g). Calcular las concentraciones en el equilibrio.
Grado de disociación de una electrolito débil y fuerte
- Calcule las concentraciones iónicas de los siguientes electrólitos:
- Ca(NO3)2 en disolución 0,028 mol/L
- NaCI en disolución 0,01 mol/L
- 1,815 g de KAl (SO4)2 disuelto en 125 mL de agua
- Para cada solución, identifique los iones que existen en la solución acuosa y especifique la concentración de cada uno.
- 0,25 mol/L (NH4)2SO4
- 0,123 mol/L Na2CO3
- 0,56 mol/L HNO3
- 0,12 mol/L BaCl2
- 0,0125 mol/L CuSO4
- 0,500 mol/L K2Cr2O7
3. Se disuelve 2,335 g de dicromato de potasio K2Cr2O7 en suficiente agua para preparar exactamente 500 mL de solución. ¿Cuál es la concentración molar del dicromato de potasio?, ¿Cuáles son las concentraciones molares de los iones K+ y Cr2O7 =?
4. ¿Cuál es la masa en gramos de soluto en 125 mL de una solución 1,023×10-3 mol/L de Na3PO4?, ¿Cuáles son las concentraciones molares de los iones Na+ y PO4-3?
5. En la reacción general: AB ⇔ A+ + B–, se supone que las concentraciones de A+ y B– en el punto de equilibrio son 0,003 mol/L. La concentración de AB no disociada es 0,1 mol/L. Calcule la constante de disociación.
6. ¿Cuál será el grado de disociación para la disolución del ejemplo 2?
7. He aquí el siguiente equilibrio general: A2B3 ⇔ 2A+3 + 3B. En el equilibrio la disolución es 0,002 mol/L con respecto a A3+ y 0,003mol/L con respecto a B=. La concentración de la «molécula» no disociada A2B3 es 0,1mol/L. ¿Cuál será la constante de disociación para la reacción y el grado de disociación en la disolución?
Cambios en el equilibrio iónico
- Al principio de una reacción, hay 0,249 mol de N2; 3,21×10-2 mol de H2 y 6,42×10-4 mol de NH3 en un matraz de 3,50 litros a 375°C. Si la constante de equilibrio para la reacción es 1,2 a esta temperatura, determine si el sistema está en equilibrio. Si no es así, prediga en qué dirección procederá la reacción neta.
N2(g) + 3H2(g) ⇔ 2NH3(g)
2. La constante de equilibrio para la formación del cloruro de nitrosilo, un compuesto de color amarillo-naranja, a partir de óxido nítrico y cloro molecular:
2NO(g) + Cl2(g) ⇔ 2NOCl(g)
Tiene un valor de 6,5×104 a 35°C. En un experimento se mezclan 2,0×10-2 mol de NO; 8,3×10-3 mol de Cl2 y 6,8 mol de NOCl en un matraz de 2,0 litros. ¿En qué dirección procederá el sistema al alcanzar el equilibrio?
3. A 720°C, la constante de equilibrio Kc para la reacción: N2(g) + 3H2(g) ⇔ 2NH3(g) es de 2,37×10-3. En un experimento determinado, las concentraciones en el equilibrio son: [N2] = 0,683 mol/ l, [H2] = 8,80 mol/L y [NH3] = 1,05 mol/L. Suponga que se añade cierta cantidad de NH3 a la mezcla de modo que sus concentración se incrementa a 3,65 mol/L.
- Usando el principio de Le Chatelier, prediga el cambio en la dirección de la reacción neta para que se alcance el nuevo equilibrio.
- Confirme su predicción calculando el cociente de la reacción Q y comparando su valor con el de K.
4. Considere los siguientes sistemas en equilibrio
- 2PbS(s) + 3O2(g) ⇔2PbO(s) + 2SO2(g)
- PCl5(g) ⇔ PCl3(g) + Cl2(g)
- H2(g) + CO2(g) ⇔ H2O(g) + CO(g)
Prediga, en cada caso, la dirección de la reacción neta al aumentar la presión (disminución del volumen) del sistema a temperatura constante.
5. Considere la reacción de equilibrio en la que participan cloruro de nitrosilo, óxido nítrico y cloro molecular: 2NOCl(g) ⇔ 2NO(g) + Cl2(g). Prediga la dirección de la reacción neta como consecuencia de que disminuya la presión (incremento de volumen) del sistema a temperatura constante.
6. Para el sistema; ΔH = 98 Kcal, explique qué ocurrirá en el sistema en equilibrio si se aumenta la temperatura: A2(g) + B2(g) ó 2AB(g)
7. En el ejercicio anterior, Si se desea producir mayor cantidad de AB que temperatura recomendaría (alta o baja)
8. La reacción A(s) + B2(g) ó AB2(g) es exotérmica. Si el sistema alcanza el equilibrio y luego es perturbado aumentando la temperatura. Explique ¿Qué ocurrirá?.
10. La producción de amoniaco, NH3, se realiza a partir de la reacción exotérmica entre nitrógeno, N2 e hidrógeno, H2, tal como se muestra a continuación:
N2(g) + 3H2(g) ⇔ 2NH3(g) ΔH= -92,6 KJ
Si el sistema ésta en el equilibrio, suponga que usted ha sido contratado para obtener un alto rendimiento de producto (NH3) a un bajo costo. Tomando en cuenta las tres variables que pueden afectar el equilibrio: concentración, presión y temperatura, ¿Cuáles y cómo manipularía usted (aumento o disminución) para garantizar una mayor producción del producto? Explique su propuesta.
Referencias
- Chang, R. (1999). Química. México: Mc Graw Hill. Sexta edición.
- Hamilton, L., Simpson, S.(1971). Cálculos de Química Analítica. México: McGraw Hill
- Skoog D, West D, Holler F., Crouch S. (2005).Fundamentos de química analítica. México: Thomson